- EN
- 最新股价:
2024年7月30日,中国国家药品监督管理局 (NMPA) 药品审评中心(CDE)同意香雪生命科学(XLifeSc)的TAEST16001注射液纳入突破性治疗品种名单,标志着该产品作为中国第一个IND获批开展临床试验的TCR-T细胞治疗新药取得重大突破,可加快关键性临床试验和附条件批准上市的进程,有望成为中国第一款上市的TCR-T细胞治疗药物,对中国免疫细胞治疗创新药的发展具有里程碑的意义。
香雪生命科学搭建了自主开发创新平台,突破TCR-T细胞免疫治疗关键技术,在国内肿瘤细胞免疫治疗领域处于领先地位,达到国际水平,研发的产品可代表广州和中国参与全球竞争,造福患者和社会,成为助力大湾区生物医药产业高质量发展的新标杆。
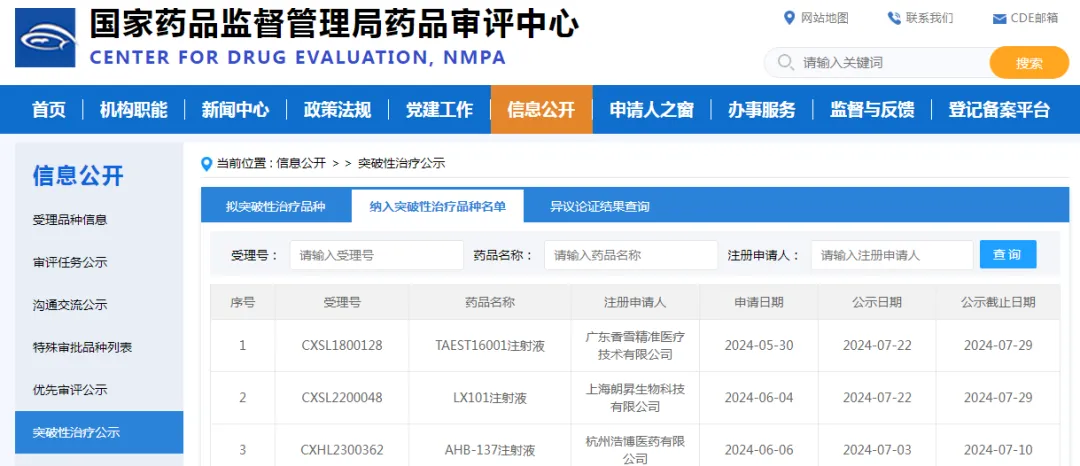
关于突破性治疗
随着基础医学的进步和对疾病认识的不断深入,新药研发越来越具有目的性和方向性。在多学科共同发展的推动下,涌现出不少机制和疗效都具有突破性意义和颠覆性改变的创新产品。CDE在2020年07月发布和实施《突破性治疗药物审评工作程序(试行)》,针对用于防治严重危及生命或严重影响生活质量的疾病、对于尚无有效治疗手段的,可以提供有效防治手段或与现有治疗手段相比具有更明显临床优势,通过早期临床研究数据发掘出具有突出临床优势的创新药物纳入突破性治疗品种名单,通过优化临床研发的资源配置,缩短其临床研发周期,可加快产品获批上市的进程,使罹患严重危及生命或严重影响生存质量疾病的患者早日获得更好的治疗。
CDE认定的突破性治疗药物是选择关注更优秀的临床数据、更差异化的临床靶点、更确定性的疗法,是探寻有价值新药项目的最高切入点。同时,CDE将纳入突破性治疗药物程序列为药品加快上市注册程序,这一工作程序受到了药品研发行业的普遍关注,突破性治疗药物的认定标准也成为业界和学术界关心的焦点之一。
软组织肉瘤是一组来源于间叶组织的实体恶性肿瘤,恶性程度高常规治疗效果差,临床存在较大的未被满足的临床需求。香雪生命科学研发的TCR-T细胞治疗新药TAEST16001 注射液,在针对NY-ESO-1阳性及HLA-A02:01阳性无治疗选择的晚期软组织肉瘤临床试验的数据显示了显著临床意义的治疗效果,是具有突破性和颠覆性的创新药品纳入CDE突破性治疗品种,在药审中心的指导下为加快开展关键性临床试验和附条件批准上市的进程创造条件,成为中国第一个获批上市的TCRT细胞治疗创新药物。
关于TAEST16001
TAEST16001注射液是基于香雪生命科学TCR-T细胞产品技术开发平台和生产制备体系开发的第一个TCR-T细胞治疗产品,是将病人的T细胞在体外用基因工程改造,把带有NY-ESO-1肿瘤抗原特异性的TCR基因的慢病毒转染T细胞后体外扩增,再把TCR-T细胞回输给病人,达到有效治疗肿瘤的目的。
TAEST16001是中国首个获得IND批件并开展临床研究的TCRT细胞产品,第一个适应症为HLA-A*02:01阳性并且表达NY-ESO-1抗原的晚期软组织肉瘤,以广州中山大学肿瘤防治中心和北京大学肿瘤医院作为牵头单位开展临床试验,目前已完成I期临床试验和II期临床试验第一阶段的研究工作,对经标准全身系统治疗失败而缺乏有效治疗选择晚期软组织肉瘤的人群,在临床试验中观察到显著临床意义的疗效和可控的安全性。TAEST16001的I期临床试验结果获得2022年美国临床肿瘤学会(ASCO)年会得认可在肉瘤专场进行口头汇报,在会中首次公开临床试验数据结果显示肿瘤客观缓解率(ORR)达到41.7%,其安全性和有效性的临床研究结果与国外知名药企同靶点产品的临床结果相当,获得了全球参会同行的认可和业界的高度关注。TAEST16001的I期临床试验结果于2023年8月刊登在国际著名期刊Cell Reports Medicine(IF=16.988),该期期刊特邀了美国西北大学教授对该文章作了特别点评并给予高度评价,认为TAEST16001的I期临床研究为过继性T细胞免疫疗法在晚期软组织肉瘤的临床转化中迈出关键一步。2024年6月TAEST16001的II期临床试验阶段性总结数据再次入选ASCO年会,以墙报的形式首次公开数据显示根据RECIST1.1,由独立影像评估委员会(IRC)评估的最佳缓解率为50%,由独立影像评估委员会和研究者评估的中位无进展生存期(mPFS)均为5.9个月,TAEST16001观察到显著临床意义疗效得数据再次得到国际顶级学术会议的认可。
关于香雪生命科学
香雪生命科学技术(广东)有限公司(简称“香雪生命科学”) 是香雪制药控股的子公司,是一家聚焦TCR领域的细胞免疫治疗产品和技术的研发企业,是TCR-T细胞免疫治疗的头部企业。公司以“解决人类健康难点,树立肿瘤治疗标杆”为愿景,以“聚焦TCR,赋能T细胞,攻克实体瘤”为使命。
香雪生命科学具有自主知识产权的TCR核心技术,拥有完整的TCR-T细胞治疗产品技术研发平台和生产制备体系,其中TCR-T细胞治疗产品技术研发平台包含:①抗原肽发现平台,②TCR高亲和力平台,③TCR-T开发平台;TCR-T细胞治疗产品生产制备体系包含:①自动化细胞生产平台,②质控平台,已形成TCR-T细胞产品全链条得创新产业链。
香雪生命科学TCR-T产品和储备管线布局广泛,靶点丰富涉及包括CT抗原、新生抗原和病毒抗原等几乎所有与肿瘤相关的特异性抗原,涵盖A0201、A1101及A2402等多个以中国人群居多的HLA基因型,适应症覆盖多种临床难治的实体瘤,处于国际领先水平。
目前,香雪生命科学有两个产品已在中国获得IND批件,其中第一个产品是TAEST16001,适应症为软组织肉瘤,目前在中国完成I期临床试验和II期临床试验第一阶段的研究工作,纳入突破性治疗品种名单,在美国获得IND批件;第二个产品是TAEST1901,适应症为原发性肝癌,正在启动I期临床研究。第三个产品XLS103,适应症为晚期胰腺癌、非小细胞肺癌和大肠癌,正在进行IND申报。
 香雪制药
香雪制药 香雪精准
香雪精准